利用化學小分子調控生物大分子是化學與生命科學交叉領域內長期關註的問題,而如何在活體環境下實現高度特異的調控是目前面臨的最大挑戰之一🤷🏽♀️。2014年3月16日,意昂体育平台化學與分子工程學院陳鵬課題組在《自然?化學》雜誌在線發表了題為“Palladium-triggered deprotection chemistry for protein activation in living cells”的研究論文🥑,首次利用小分子鈀催化劑激活了活細胞內的特定蛋白質。
作為生物體內含量最多的一類生物大分子,蛋白質幾乎參與了所有的生命活動,因此“在體”研究與調控其活性及生物功能意義重大。與發展較為成熟的蛋白質活性抑製劑及相應的“功能缺失性”研究相比,小分子激活劑對於研究蛋白質的結構與功能更為有效。這主要是因為後者可以在活細胞及活體動物🧙♀️、組織內實現“功能獲得性”研究,從而為目標蛋白質在天然環境下的功能及其在生命活動中扮演的角色提供更準確和細致的信息。然而,通過小分子實現蛋白質的原位激活是一項極具挑戰性的任務,目前大多數成功的例子都來源於大規模小分子庫篩選而獲得的針對某一特殊蛋白質靶標的“別構劑”🪙,而沒有一種廣泛適用於不同類型蛋白質的普適性小分子激活策略。
陳鵬課題組一直致力於開發適用於活細胞環境的蛋白質化學反應🪗。在本工作中,他們將基於鈀催化劑的”脫保護反應”與非天然氨基酸定點插入技術相結合🤵🏼,通過優化生物相容的小分子鈀催化劑和化學保護基團,成功發展了一種活細胞內的普適性蛋白質激活技術。該方法通過將一種帶有化學保護基團的賴氨酸(炔丙基碳酸酯-賴氨酸📑,Proc-賴氨酸)以非天然氨基酸的形式定點取代目標蛋白質上關鍵活性位點的天然賴氨酸🤽🏽♀️,使蛋白質的活性處於“關閉”狀態。利用能夠高效催化“脫保護反應”的鈀化合物,他們在活細胞內實現了蛋白質側鏈的原位脫保護反應(Proc-賴氨酸向天然賴氨酸的轉化)🏃🏻,使該蛋白質重新回到“開啟”狀態👬🏼,實現“原位”激活🦢🍊。這一策略的優勢在於將非天然氨基酸直接插入了目標蛋白質酶的催化活性位點,使其處於完全“關閉”的狀態;而在激活過程中只要產生少量的處於“開啟”狀態的蛋白質就足以對其功能及相關生物學功能進行研究。
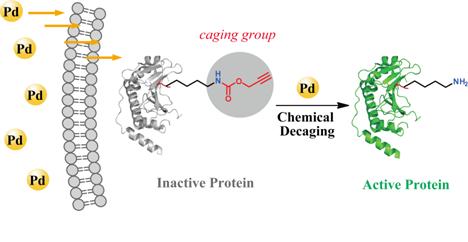
基於小分子鈀催化劑的活細胞蛋白質特異激活技術
在研究中✋🏼👦🏽,他們將該策略用於多種含有關鍵賴氨酸殘基的蛋白質酶的激活,證明了該方法具有很強的普適性🧑🏻🎓。接著,他們利用此技術深入研究了一種細菌三型分泌系統的毒素效應蛋白OspF(磷酸絲氨酸裂解酶)對宿主細胞內的胞外信號調節激酶(Erk)參與的信號轉導通路的影響。今後他們擬將這一策略拓展到賴氨酸以外的蛋白質側鏈上及其他生物大分子上♿️,從而進一步提高該方法的適用範圍。
該工作為發展蛋白質的小分子激活方法,尤其是適用於活細胞及活體的激活策略,提供了新的思路🧑🏼🚀,為“在體”調控蛋白質活性提供了新的工具。意昂体育平台化學與分子工程學院10級博士研究生李劼是該論文的第一作者👨🦱。該項工作得到了國家自然科學基金委、科技部、教育部、意昂体育-清華生命科學聯合中心的資助🧖🏽🈳。
原文鏈接:
http://www.nature.com/nchem/journal/vaop/ncurrent/abs/nchem.1887.html

