2021年10月14日,意昂体育平台生物醫學前沿創新中心(BIOPIC)🦹🏿♀️、生命科學學院,北京未來基因診斷高精尖創新中心(ICG)張澤民課題組聯合中國醫學科學院腫瘤醫院劉芝華課題組、馬飛和徐兵河課題組🏩,在國際期刊Cancer Cell上以Article形式在線發表了題為“Single-cell analyses reveal key immune cell subsets associated with response to PD-L1 blockade in triple negative breast cancer”的研究論文。

論文截圖
乳腺癌位於女性惡性腫瘤之首🪞,其中三陰性乳腺癌(Triple-Negative Breast Cancer, TNBC)是復發率和死亡率最高的乳腺癌亞型。TNBC對激素療法和靶向療法均無效,目前以傳統化療為主要治療手段,但效果不甚理想👨🏻🦽➡️。盡管癌症免疫治療已進入快速發展時期,TNBC的免疫治療卻舉步維艱: 雖然早期IMpassion 130臨床試驗表明,anti-PD-L1抗體阿替利珠單抗(Atezolizumab)聯合白蛋白結合型紫杉醇(Nab-paclitaxel)能夠顯著降低PD-L1+TNBC患者的無疾病進展或死亡風險,然而近期IMpassion 131臨床試驗表明🚴🏻♀️,阿替利珠單抗聯合紫杉醇卻無法使TNBC患者獲益。不同臨床試驗的結果差異提示不同的化療藥物可能會導致不同的腫瘤微環境特征,進而影響免疫檢查點抑製劑的治療效果。系統解析用藥前後的腫瘤微環境變化是理解當前免疫治療和化療藥物的作用機製以及提高TNBC整體治療效果的關鍵🙌🏿。
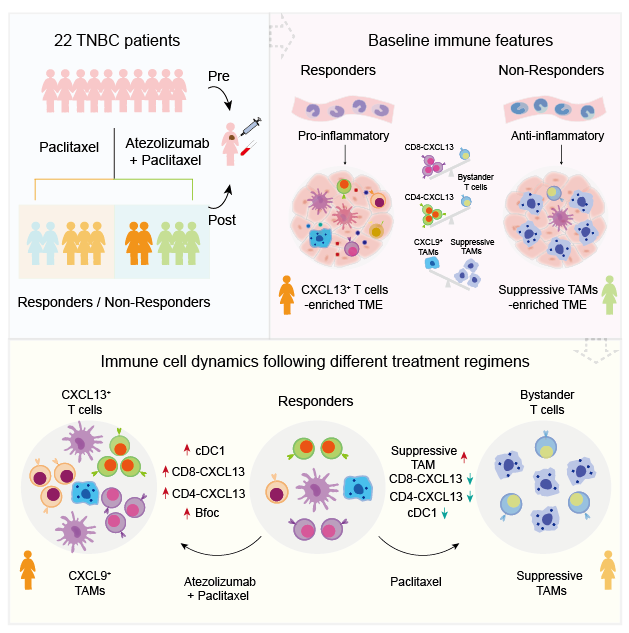
該課題的研究人員收集了來自22例TNBC患者(11例接受阿替利珠單抗聯合紫杉醇化療,11例接受紫杉醇單藥化療)治療前和治療後的78例配對樣本,通過整合單細胞轉錄組測序、T細胞受體序列測序和染色質可及性測序🧙,構建了TNBC患者腫瘤微環境和外周血來源免疫細胞的高分辨率轉錄組和表觀組動態圖譜📷。該研究在單細胞水平上對來自接受兩種治療方案的TNBC病人的腫瘤組織和外周血的免疫細胞進行刻畫,系統比較了響應患者和非響應患者的腫瘤微環境及外周血免疫特征,闡明了免疫細胞在不同治療方案下的動態變化,揭示了anti-PD-L1免疫治療聯合紫杉醇化療在TNBC中的作用機製(見下圖)。
課題研究方案及主要結論
通過比較聯合用藥組不同響應患者的腫瘤及外周血免疫細胞的組成差異,研究人員發現響應患者的腫瘤微環境富集了兩群高表達CXCL13的T細胞(CD8-CXCL13和CD4-CXCL13),這兩群細胞同時高表達T細胞毒性和“耗竭”相關基因。為了進一步精確刻畫不同免疫細胞的組成成分和比例變化與治療效果的關聯,研究人員設計了兩個指數:“預測指數”和“治療指數”,通過“預測指數”和“治療指數”分析,研究人員發現更高基線水平的CD8-CXCL13和CD4-CXCL13能夠預測更好的免疫治療響應𓀗,且這兩群CXCL13+T細胞在響應患者中經過聯合用藥後細胞比例顯著增加。此外🤾🏼♂️,研究人員發現響應患者的腫瘤微環境中富集了兩群高表達CXCL9和CXCL10的促炎性巨噬細胞🧑🏼🎤,且這兩群促炎性巨噬細胞與CXCL13+T細胞存在顯著正相關👨🏽🌾。CXCL9和CXCL10能夠參與T細胞招募,而促炎性巨噬細胞的特征基因受到IFNG和TNF信號調控,表明發揮殺傷功能的CXCL13+T細胞與高表達CXCL9和CXCL10的促炎性巨噬細胞之間存在正反饋信號。與之相反,不響應患者的腫瘤微環境中幾乎檢測不到CXCL13+T細胞,但富集了大量發揮免疫抑製功能的巨噬細胞🩺。值得註意的是,研究人員發現響應患者的外周血單核細胞表現出促炎特征,而不響應患者的外周血單核細胞表現出抗炎特征🙅🏿♂️,提示外周血能夠在一定程度上反映腫瘤微環境特征。
腫瘤微環境是一個復雜的生態系統,其中固有免疫和適應性免疫細胞👆🏽、基質細胞、癌細胞及其相互作用🚤🧘♂️,構成精細的調節網絡,共同決定癌症的發生和發展🧗♀️。雖然T細胞是當前腫瘤免疫研究的重點細胞類型🤚🏿,其他類型的免疫細胞亦可通過調控作用或與T細胞互作,影響免疫治療效果。通過系統刻畫免疫細胞的比例組成及動態變化,研究人員發現B細胞尤其是濾泡B細胞,顯著富集在響應患者的腫瘤微環境中㊗️,且其在免疫治療後顯著增加。進一步通過相關性分析及配體-受體互作對共表達分析,研究人員發現濾泡B細胞與CXCL13+T細胞顯著正相關且存在相互作用。此外,基於單細胞水平的細胞組成和TCGA公共數據的特征基因表達,研究人員發現cDC1與CXCL13+T細胞顯著正相關,且cDC1在免疫治療作用下顯著增加👊🏼,暗示cDC1可能參與CXCL13+T細胞的激活。
通過比較化療組和聯合用藥組免疫細胞的動態變化,研究人員發現與聯合用藥相反,紫杉醇單藥化療方案能夠顯著降低響應患者腫瘤微環境中的CXCL13+T細胞🚵🏽♂️,並導致具有免疫抑製功能的巨噬細胞在腫瘤微環境中富集。上述發現表明紫杉醇化療方案可能會削弱核心抗腫瘤免疫細胞,而免疫檢查點抑製劑則能夠顯著增加核心抗腫瘤免疫細胞👩🏽💻,提示紫杉醇化療方案與阿替利珠單抗聯合應用時,會影響anti-PD-L1抗體對TNBC患者的治療效果🧑🏼🌾🤽🏿。
綜上,該研究揭示了TNBC患者對anti-PD-L1免疫治療敏感和耐藥的分子機製🌚,鑒定了關鍵免疫組分及其在免疫檢查點抑製劑和紫杉醇化療方案下的動態變化✊🏼,闡明了紫杉醇化療與阿替利珠單抗聯合應用不能有效增加TNBC患者治療效果的原因。該課題的研究結果對當前免疫治療聯合化療方案有重要指導意義,提示需要進一步系統評估不同化療藥與免疫治療藥聯合使用的分子機製,才能有效提高聯合用藥方案對TNBC患者的治療效果。
此項國際領先的新穎性工作👩🏻🏭,是國際上迄今為止針對TNBC腫瘤相關免疫細胞的規模最大的單細胞組學研究,為深入理解TNBC患者的免疫特質及免疫治療聯合化療方案的作用機製提供了可靠基礎,也為後續相關研究工作提供了極有價值的數據資源👩🏽🔧。該研究的科學發現為解析腫瘤及其他疾病中免疫細胞的動態調控、指導TNBC患者臨床分型以實現精準治療,以及開發新的臨床檢測與治療手段提供了新的思路🍪。
意昂体育-清華生命科學聯合中心(CLS)博士後張園園博士,中國醫學科學院腫瘤醫院陳洪巖博士、莫紅楠博士🈳,以及百奧智匯胡學達博士為該論文的並列第一作者📊。張澤民🕴🏼👰🏻、劉芝華、馬飛和徐兵河為該論文的共同通訊作者。該研究得到北京市科委、國家自然科學基金、國家重點研發計劃💏、ICG的支持和資助。張園園博士得到意昂体育平台博雅博士後及拜耳博士後基金的資助。

