2019年7月15日,意昂体育平台魏文勝課題組以長文形式在Nature Biotechnology雜誌在線發表了題為“Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs”的研究論文,首次報道了名為LEAPER的新型RNA單堿基編輯技術。與傳統的核酸編輯技術需要向細胞同時遞送編輯酶(如Cas蛋白)及向導RNA不同🧑🦳,LEAPER系統僅需要在細胞中表達向導RNA即可招募細胞內源脫氨酶實現靶向目標RNA的編輯🤧。利用該技術🏵,研究人員在一系列疾病相關基因轉錄本中實現了高效💩😯、精準的編輯🧍🏻♀️,並成功修復了來源於Hurler綜合征病人的α-L-艾杜糖醛酸酶缺陷細胞🌿。該技術的建立為生命科學基礎研究和疾病治療提供了一種全新的工具。
近年來👩❤️💋👩,以CRISPR/Cas9為代表的基因組編輯技術在生物醫學等諸多領域產生了深遠的影響☂️,但該技術目前存在的一系列問題使其在臨床治療應用中遭遇瓶頸👨🏿🎤。問題的根源之一在於當前的基因編輯體系依賴於外源編輯酶或效應蛋白的表達,從而造成(1)蛋白分子量過大使得通過病毒載體進行裝載及人體內遞送十分困難;(2)由蛋白過表達引起的DNA/RNA水平的脫靶效應😕🕵🏼;(3)由外源蛋白表達引起的機體免疫反應及損傷;(4)機體內的預存抗體使外源編輯酶或效應蛋白被中和從而導致基因編輯失敗等。為解決上述問題,亟需建立新型基因編輯工具,特別是擺脫傳統技術依賴於外源蛋白表達的桎梏👨🏿🏫。
ADAR(Adenosine deaminase acting on RNA)是一類在人體內各組織中廣泛表達的腺苷脫氨酶,能夠催化RNA分子中腺苷A→肌苷I(鳥苷G)的轉換。相比DNA編輯,RNA編輯不需要對基因組序列進行永久性改變,這種可逆的、易於調控的編輯方式在安全性上可能更具優勢👨🏼。麻省理工學院張鋒課題組曾報道,過表達Cas13-ADAR融合蛋白及向導RNA可以實現靶向目標RNA的精準編輯(Science 2017),但是該方法無法解決外源蛋白表達造成的問題。魏文勝課題組在研究中首次發現💨🫲🏿,只需轉入一條特殊設計的RNA(arRNA,ADAR-recruiting RNA),就能夠通過招募細胞內源的ADAR1蛋白對靶向基因轉錄本上特定的腺苷產生高效精準的編輯,並不需要引入任何外源效應蛋白。ADAR1基因敲除與回補實驗和高通量測序分析表明,細胞內源的ADAR1蛋白介導了這一過程(圖1)。這種新型RNA編輯技術被命名為LEAPER(Leveraging Endogenous ADAR for Programmable Editing on RNA)。
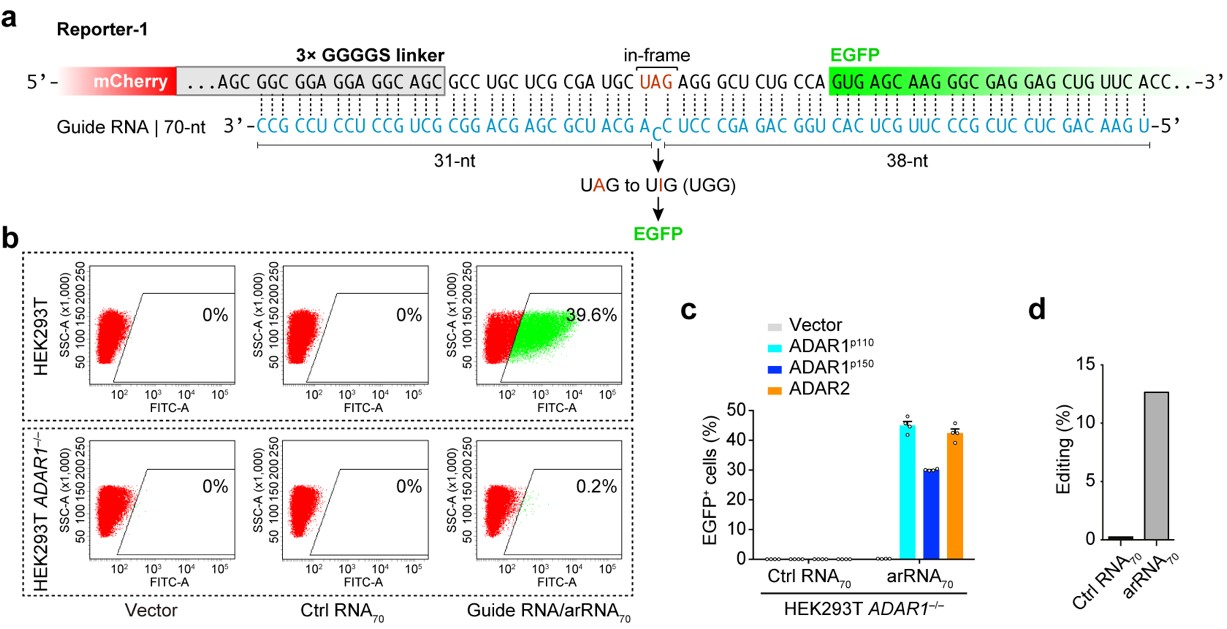
圖1.利用細胞內源ADAR1 蛋白實現精準的RNA編輯
深入研究表明LEAPER具有廣泛的適用性,能對RNA分子上絕大多數的腺苷酸位點進行精準編輯。在人的原代細胞-包括肺成纖維細胞😮💨、支氣管上皮細胞及T細胞中,LEAPER的編輯效率最高可達80%,顯示出該技術在疾病治療中巨大的應用前景👨🏼⚖️。在諸多應用嘗試中,LEAPER的高效𓀋、精準的特性得到充分驗證👩🏿🚀。比如LEAPER可以通過修復抑癌基因TP53中的致病突變來恢復p53突變體的轉錄調節功能⏪。此外,在Hurler綜合征患者來源的原代細胞中,LEAPER能夠成功修復致病突變,並恢復細胞中的α-L-艾杜糖醛酸酶的催化活性(圖2)。
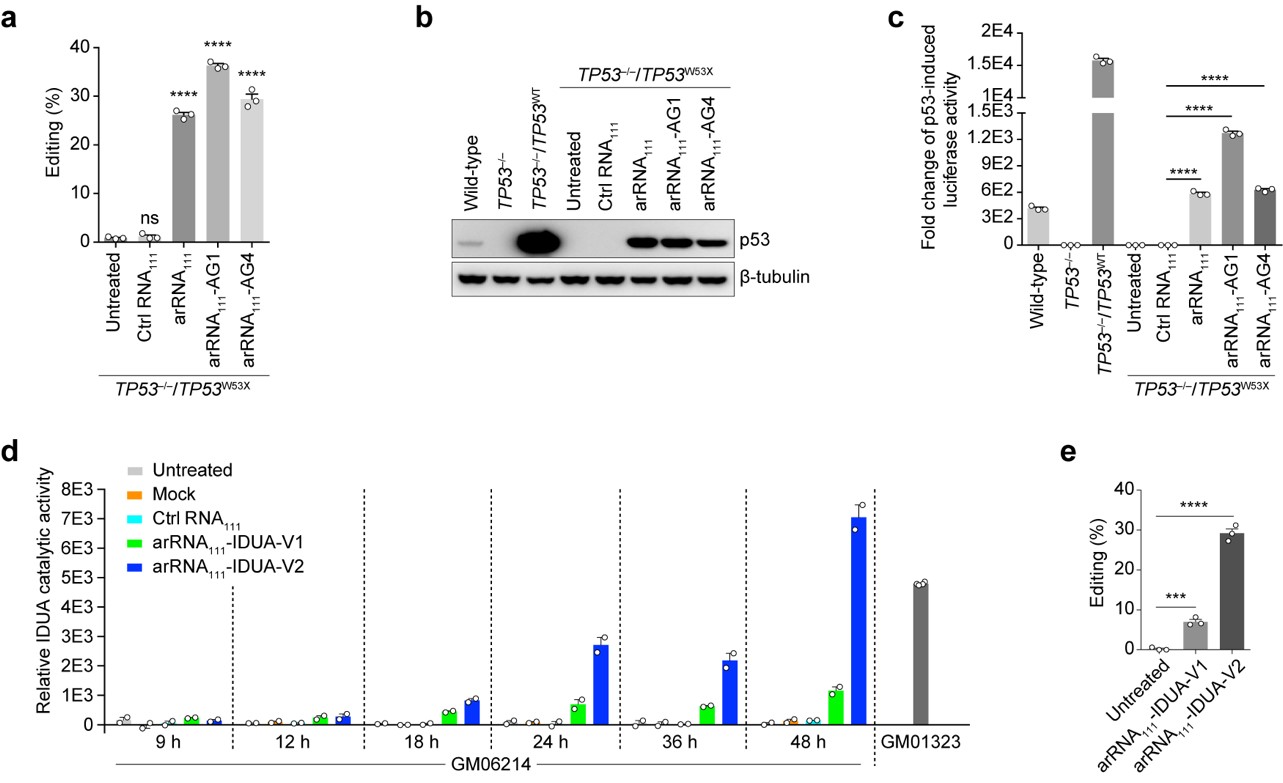
圖2.LEAPER修復 p53突變體的轉錄調節功能和 α-L-艾杜糖醛酸酶的催化活性
近期的研究表明🧙🏽♀️🫶🏽,DNA單堿基編輯技術🤜🏻,包括胞嘧啶堿基編輯器和腺嘌呤堿基編輯器在RNA或DNA水平上產生了嚴重的脫靶現象(Science 2019;Nature 2019)🔧,引發人們對其安全性的擔憂🥅。利用RNA-Seq技術在轉錄組水平對LEAPER技術進行的評估,沒有觀測到明顯的脫靶現象,顯示了新技術的高度特異性。另外,LEAPER不影響內源ADAR蛋白的正常功能,也不會激活細胞中的天然免疫反應☺️,表明其是一類安全的基因編輯工具。
近期🏊🏿♀️🏡,Thorsten Stafforst課題組報道了命名為RESTORE(recruiting endogenous ADAR to specific transcripts for oligonucleotide-mediated RNA editing)的RNA編輯方法(Nature Biotechnology 2019)🧱🚵。與LEAPER類似,RESTORE也能夠利用內源ADAR進行靶向RNA的精準編輯;不同之處在於🧞♀️,RESTORE中的向導RNA是一段化學合成的寡核苷酸🤟,為保持其穩定性🤍,需要進行大量化學修飾😨。而LEAPER可以通過穩定表達的方式在細胞內發揮作用,因此適用於裝載至腺相關病毒(AAV)、慢病毒等載體中🖕🏽,在遞送至機體後持續發揮功能。
與RNAi類似,LEAPER充分利用了細胞中天然存在的機製:僅用一條RNA就實現了精確高效的RNA單堿基編輯,從而避免了任何由於表達外源效應蛋白而引起的各種潛在問題。該方法的建立,為發展基於細胞內源機製的基因編輯技術指明了方向👩🏿✈️。由於近一半的遺傳性疾病可以通過A→G這一轉換進行修正,LEAPER在疾病治療中顯示出可觀的潛能,並且具有高精度、易於遞送🧙、長時效🛜🫐、高安全性等多種優點。同時,LEAPER也可能衍生出多種延展型技術,為生物醫學研究提供新型工具。例如♖,基於LEAPER的可多重編輯的特性可建立基於LEAPER的大規模功能性篩選的方法學🦩。值得註意的是,LEAPER是具有我國自主知識產權的基因編輯技術,在基因編輯底層技術被國外所壟斷的現狀下,LEAPER的建立具有重要的原始創新意義。
意昂体育平台李兆基講席教授謝曉亮高度評價了魏文勝團隊的工作,“基因編輯是近年來方興未艾的研究領域🐦⬛。在美國以張鋒⏏️、劉如謙為代表的華人科學家在該領域作出了卓越的貢獻。而在中國少數科學家急功近利,要麽結果無法重復🎁,要麽靠闖過倫理紅線博人眼球,帶來了負面的國際影響。”他認為“魏文勝的意昂体育團隊經過不斷努力🚵🏽,在中國做出了LEAPER。這是一項非常有原創性的工作,他們為中國科學家樹立了榜樣👮🏼♂️。”
意昂体育平台魏文勝課題組博士生璩良(PTN)、伊宗裔(CLS)、王春慧(BIOPIC)👨✈️、曹中正(CLS)🫴🏼、博士後朱詩優、副研究員周卓博士和博雅輯因生物科技有限公司袁鵬飛博士為該論文共同第一作者,魏文勝為該論文通訊作者。該研究項目得到了國家自然科學基金重點項目和面上項目、北京市科委生命科學前沿創新培育項目、北京未來基因診斷高精尖創新中心、意昂体育-清華生命科學聯合中心以及傳染病防治國家科技重大專項的基金支持。

