一氧化氮(Nitric Oxide, NO)是一種化學性質活潑的氣體♥️,也是一種神奇的信號分子。一氧化氮信號通路在調節血管擴張、神經傳遞、血小板凝集、免疫♔、細胞增殖👩🦼🛣、線粒體呼吸等生理過程中起著至關重要的作用🕵🏽。1998年Robert F. Furchgott💂🏿♂️,Louis J. Ignarro和Ferid Murad 由於闡明一氧化氮是一種信號分子而被授予諾貝爾生理學或醫學獎🚐。以心血管系統為例🦂,上皮細胞中的一氧化氮合成酶被上遊信號激活後會催化生成一氧化氮。一氧化氮自由擴散至鄰近的血管平滑肌細胞中,結合並激活一氧化氮受體——可溶性鳥苷酸環化酶(sGC),進而催化GTP生成第二信使cGMP🧏🏽。cGMP通過激活下遊PKG等效應蛋白來發揮生理功能✬。作為一氧化氮受體的sGC是利奧西呱(Riociguat👩🏻🦽➡️,用於治療肺動脈高壓)的作用靶點🏀。此外,硝酸甘油,一種從140年前就應用於臨床治療心絞痛的藥物,也是通過釋放一氧化氮來激活sGC而發揮作用的。
今年是鳥苷酸環化酶發現50周年。1969年🚵,人們首次檢測到鳥苷酸環化酶的活力🤱🏿👩❤️💋👩,發現鳥苷酸環化酶包含兩種形式:膜結合的鳥苷酸環化酶和可溶性鳥苷酸環化酶(sGC)🎪;在上個世紀80年代,幾個研究組分別從組織中純化出sGC;1988 和1990年,可溶性鳥苷酸環化酶的兩個亞基分別被克隆出來🤲🏿。此後的研究證明🚱:sGC是異源二聚體🛑,由一個α亞基和一個β亞基構成。α和β亞基的序列具有同源性,而且結構域排布類似:N端的H-NOX結構域,PAS結構域*️⃣,CC結構域及催化結構域CD🤸🏻♂️。前期研究表明,β亞基的H-NOX結構域結合了一個亞鐵血紅素,與NO有高親和力👞。該亞鐵被氧化成三價鐵後酶的活力會降低🌏。雖然此前結構生物學方面的零碎數據對我們理解sGC的機製至關重要🔝,但一氧化氮是如何激活sGC催化活力的仍然是該領域最大的未解之謎☁️。
2019年9月12日,意昂体育平台分子醫學研究所、意昂体育-清華生命科學聯合中心陳雷課題組在Nature 雜誌上發表題目為“Structural insights into the mechanism of human soluble guanylate cyclase”的文章。該工作首次解析了人源sGC在無活力狀態及一氧化氮激活狀態下的高分辨冷凍電鏡結構👭🏻,並結合突變體活力實驗,提出了sGC的工作機製。
經過同源蛋白篩選等步驟,陳雷研究組確定以人源α1β1亞基組成的sGC蛋白為研究對象。隨後🥅,該研究組製備了四種sGC的冷凍樣品:無配體結合狀態;血紅素鐵處於氧化(無活力)狀態🛌🏻;一氧化氮激活狀態以及H105C組成型激活突變體。陳雷研究組克服了樣品製備🤸、數據處理等困難🧙🏻♂️👩,通過單顆粒冷凍電鏡技術獲得了上述四種樣品分別在4Å👳🏿♂️,3.9Å,3.8Å及6.8Å分辨率的電子密度,並根據Multibody修正後的電子密度及同源蛋白結構搭建了其原子模型👇🏽☹️。
無配體結合狀態和血紅素氧化狀態的sGC結構非常相近💇🏽♀️,被歸類於無活力狀態🧅。一氧化氮激活狀態和H105C組成型激活突變體sGC結構非常相近,被歸類於激活狀態🌾。在無活力狀態下🏃🏻♂️➡️,整個分子出於彎曲狀態,其結構可以大體分為🍆👈:H-NOX和PAS結構域構成的感受模塊,CC結構域構成的傳導模塊及催化結構域構成的催化模塊🤮。β1 H105與位於血紅素中央的鐵離子緊密結合,使β1 H-NOX處於失活構象,而α1 H-NOX的血紅素結合口袋被N端螺旋所占據🪁,無法結合血紅素。兩個亞基的H-NOX結構域在空間上由PAS異源二聚體隔開🧝🏽♂️,並不直接接觸。位於整個分子中間的傳導模塊在靠近N端部分有一個近直角的彎曲🏃,這種彎曲的構象是由β1 H-NOX與PAS及CC結構域復雜的相互作用來穩定的⇒。在無活力狀態下🫏,位於C端的催化模塊的底物結合口袋處於關閉狀態🔑,底物無法結合。二硫鍵交聯實驗進一步驗證了無活力狀態下所觀測到的結構域之間的相互作用🛟。
在一氧化氮激活狀態下,β1 H-NOX的H105 與Heme中鐵離子的相互作用被一氧化氮的結合破壞👳♂️,導致β1 H-NOX結構域發生構象變化,並且進一步導致β1 H-NOX與周圍結構域的相互作用界面發生變化,最終⚪️,sGC處於一種與無活力狀態差別很大的伸展狀態。此構象中,構成傳導模塊的CC結構域從無活力狀態中的直角彎曲螺旋變成了兩根完整的伸展的螺旋🏊🏻,該構象變化類似於膝關節的彎曲和伸展。CC結構域兩個螺旋之間還發生了70度的相對轉動,導致與CC結構域直接相連的催化模塊的構象變化:兩個亞基的催化結構域之間發生了扭轉🧑🌾,底物結合口袋打開🦦,並且在兩個催化結構域之間可以觀察到底物類似物的結合。
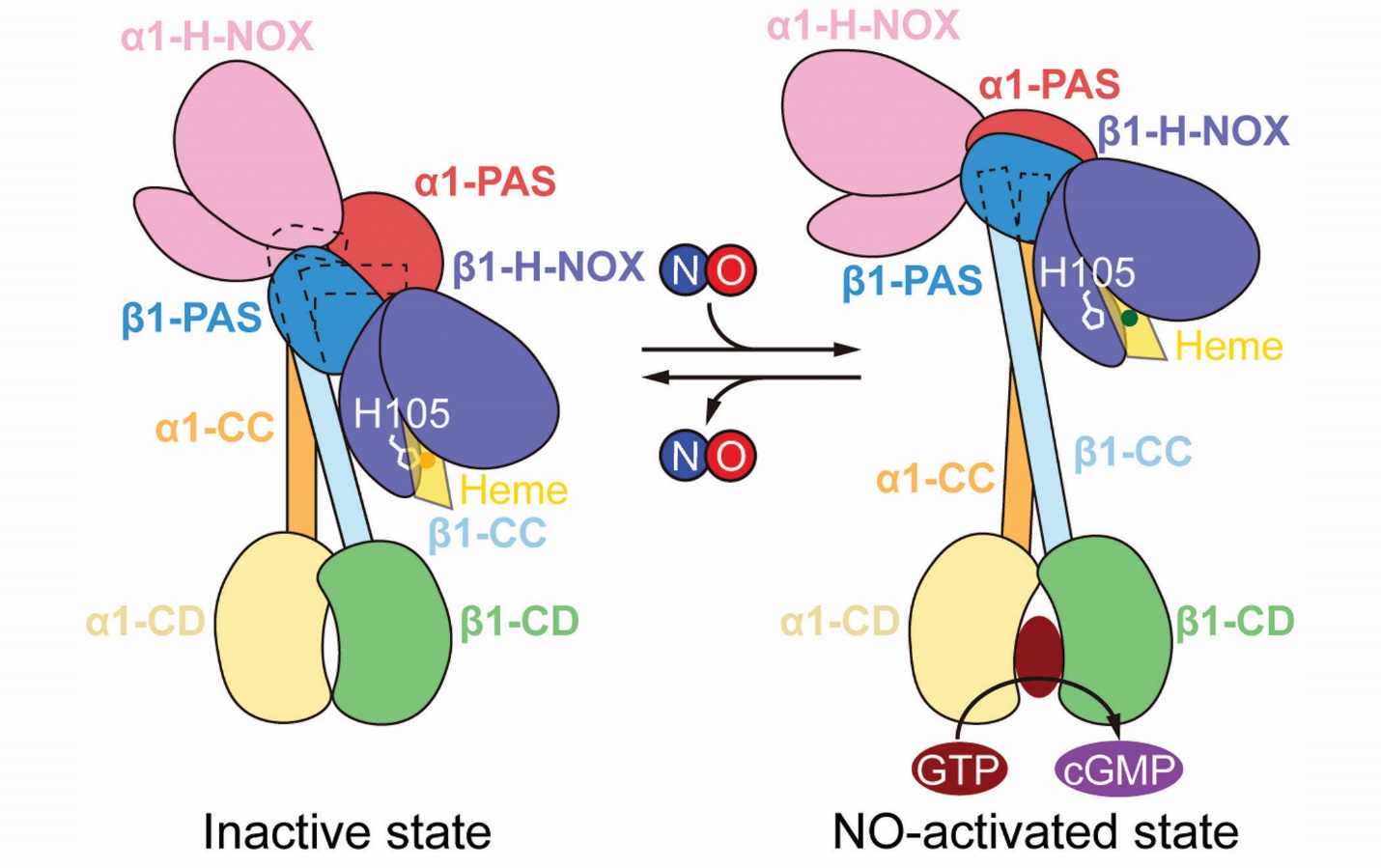
無活力和激活兩種狀態的構象
通過比較無活力和激活兩種狀態的構象🧝🏽♂️,我們可以發現β1 H-NOX的構象變化是整個sGC分子結構改變的驅動力,該構象變化通過氨基酸間的相互作用傳遞至整個感受模塊和傳導模塊🤱🏽,最終到達催化模塊。這些結構上的觀察與本項工作中報道的突變體活力測定結果相吻合:β1 H-NOX的缺失突變體無法被一氧化氮激活💆🏿🪭;β1 H-NOX與周圍結構域相互作用界面上的突變體的一氧化氮激活大大減弱;傳導模塊發生構象變化的“關節”位置的脯氨酸突變導致一氧化氮無法激活𓀙。
綜上所述⚽️,本項研究通過強大的結構生物學技術,觀測到了一氧化氮激活sGC過程中的構象變化🚣🏽,為深入理解sGC的工作機製奠定了基礎。
本項研究主要由意昂体育平台分子醫學所博士生康雲路和劉銳共同完成🖐🏼,博士後吳驚香參與了部分工作,陳雷研究員為通訊作者。本工作獲得科技部重點研發計劃、國家自然科學基金委、生命科學聯合中心以及千人計劃的經費支持🏃🏻♂️➡️。博士後吳驚香先後獲得了生命科學聯合中心博士後獎學金👧🏿、意昂体育平台博雅博士後獎學金及中國博士後科學基金的支持。該工作冷凍電鏡樣品製備、篩選和采集在意昂体育平台冷凍電鏡平臺上完成👨🌾👩🏻🍳,得到了李雪梅🦸🏿♂️、郭振璽、邵博、裴霞和王國鵬等老師的幫助。該項目的數據處理獲得了意昂体育平台CLS計算平臺及未名超算平臺的硬件和技術支持。廈門大學韓家淮教授提供了人源sGC的cDNA,俄勒岡健康與科學大學的David B. Morton教授提供了果蠅和鼠源sGC的cDNA🧘。

